蛋白质
|
[拼音]:danbaizhi [外文]:protein 生物体内普遍存在的一种主要由氨基酸组成的生物大分子。它与核酸同为生物体最基本的物质,担负着生命活动过程的各种极其重要的功能。 蛋白质的基本结构单元是氨基酸,在蛋白质中出现的氨基酸共有20种。除脯氨酸外,这些氨基酸的氨基与羧基都连接到与羧基相邻的 α碳原子上,所以称为α-氨基酸。除甘氨酸外,它们的立体结构都是 L型的。在某些蛋白质中还存在少数在多肽链生物合成过程中或完成后,经特定反应修饰产生的氨基酸,如胱氨酸,羟基脯氨酸,羟基赖氨酸等。 氨基酸以肽键相互连接,形成肽链。有些蛋白质含一条肽链,也有不少蛋白质由几条肽链通过二硫键连接而成。还有的蛋白质除肽链外,尚有其他的组成成分和基团。 从化学结构看,蛋白质和多肽的本质是相同的,两者间没有绝对的界线。一般认为,所含氨基酸多于五六十个时,就可能是蛋白质。但究竟是否是蛋白质,还要考虑到构象等其他性质。 研究简史1820年H.布拉孔诺发现甘氨酸和亮氨酸,这是最初被鉴定为蛋白质成分的氨基酸,以后又陆续发现了其他的氨基酸。1838年荷兰人G.J.米尔德首次采用“protein”(蛋白质)这一名称,它来自希腊文“proteios”一词,意为“第一位”。最初,人们把蛋白质作为生命胶态基质──原生质的同义语。1849年K.B.赖歇特获得了马血红蛋白的晶体,开始了纯化各种蛋白质的工作;以后G.J.米尔德等人系统地研究了蛋白质的元素组成,发现它与其他有机分子一样,是一种特定的分子实体。到19世纪末已经搞清蛋白质主要是由一类相当简单的有机分子──氨基酸所组成。1902年E.菲舍尔和F.霍夫迈斯特各自独立地阐明了在蛋白质分子中将氨基酸连接在一起的化学键是肽键;1907年E.菲舍尔又成功地用化学方法连接了18个氨基酸首次合成了多肽,从而建立了作为蛋白质化学结构基础的多肽理论。1923年T.斯韦德贝里建立了超离心分析技术,并应用到蛋白质的分子量测定。1939年T.斯韦德贝里提出了纯的蛋白质是一种分子量相同的均一大分子的概念。20世纪30~40年代,由于生物化学及其他有关的方法和技术的建立和发展,人们开始研究蛋白质的分子构造和理化性质,其间,超离心技术(T.斯韦德贝里,1930),电泳技术 (A.W.K.蒂塞利乌斯,1933),分配层析(钮贝格,1938),凝胶层析(A.J.P.马丁和R.L.M.辛格,1941),纸层析(R.康斯登等,1944)技术以及光散射测量,粘度测量,扩散技术等,对分离,纯化蛋白质和了解蛋白质的性质均有卓越的贡献。1947年F.桑格发现一种可以辨认蛋白质氨基端残基的试剂(1-氟-2,4-二硝基苯),使蛋白质的氨基酸序列分析成为可能。1955年F.桑格成功地测定了胰岛素分子的全部氨基酸序列,这是第一个被阐明了氨基酸序列结构的蛋白质。此后,已有上千种,包括分子量大于10万的蛋白质的氨基酸序列结构被阐明,这对深入研究蛋白质结构和功能的关系起了重要的作用,也是分子遗传学和遗传工程发展的重要基础之一,同时还把生物分类,进化等古老学科推向崭新的分子水平。 对蛋白质精确的三维结构知识主要来自对蛋白质晶体的X射线衍射分析,1960年J.C.肯德鲁首次应用X射线衍射分析技术测定了肌红蛋白的晶体结构,这是第一个被阐明了三维结构的蛋白质,至今已有上百个蛋白质分子的三维结构被阐明,使人们对蛋白质的了解又深入了一大步。 中国科学工作者在1965年用化学合成法全合成了结晶牛胰岛素,首次实现了蛋白质的人工合成;在1969~1973年期间,先后在2.5埃和1.8埃分辨率水平测定了猪胰岛素的晶体结构,这是在中国阐明的第一个蛋白质的三维结构。 20世纪60年代以来,人们对蛋白质的生物合成,核酸与蛋白质之间的相互关系等又有很多重大的发现。 分类在蛋白质研究的历史中曾出现过各种分类方法。这些分类方法主要依据蛋白质某一方面的特性,但也反应了在蛋白质研究的各个历史阶段中,人们对蛋白质的了解程度。 分子形态分类球状蛋白质分子呈球状或椭圆状,轴比小。一般溶解度较好,易结晶。 纤维状蛋白质分子细长,呈不同长度的棒状或纤维状,多数溶解度较差。 溶解性质分类水溶性蛋白质易溶于水,一般也易溶于稀酸、稀碱和稀盐溶液。如白蛋白(清蛋白)广泛存在于蛋清中;组蛋白,主要存在于细胞核中,分子中含有很高比例的碱性氨基酸──组氨酸、赖氨酸和精氨酸,呈弱碱性;鱼精蛋白,鱼类的精子蛋白质,分子含有大量的精氨酸,呈强碱性。 盐溶蛋白质溶于稀的中性盐溶液,但不溶或难溶于水。大多数球蛋白(及优球蛋白)均属此类。 酸和碱溶蛋白质溶于稀酸和稀碱,但不溶于水和稀盐溶液。如谷蛋白,包括麦谷蛋白、米谷蛋白等。 醇溶蛋白质溶于50~80%的乙醇,但不溶于水,在植物种子中发现较多,如玉米醇溶蛋白、麦醇溶蛋白等。 硬蛋白不溶于水和盐溶液,也不溶于稀酸和稀碱,这一类蛋白质大都在动物体内起支持和保护作用,如角蛋白、弹性蛋白。 化学组成分类单一蛋白质仅含有氨基酸的蛋白质。 结合蛋白质化学组成中除氨基酸外还含有各种非氨基酸物质,称为辅基或配体。结合蛋白质还可进一步分成: (1)核蛋白。在自然状态下存在的核蛋白有核精蛋白、核酸组蛋白等、病毒可以看成是一种核蛋白,复杂的病毒如弹状病毒中,由负链RNA与3种以上病毒结构蛋白质形成结构紧密的核衣壳也是一种核蛋白。 (2)磷蛋白。一类和磷酸相结合的蛋白质。蛋白质中的丝氨酸、苏氨酸和酪氨酸残基的侧链能分别被磷酸化。 (3)糖蛋白。在唾液、胃液、软骨、关节液、血清、蛋清以及细胞液中有种类繁多的糖蛋白存在。糖蛋白的辅基是一种低聚糖──氨基多糖,一般含有 4~12个糖分子。最普遍的是半乳糖、甘露糖、氨基葡糖、半乳糖胺,有时还有木糖、岩藻糖、葡糖醛酸和唾液酸。这些组分通常经由0-糖苷键与蛋白质的丝氨酸或苏氨酸共价结合,也有通过末端还原,在糖与肽链的天冬酰胺或谷氨酰胺的酰氨基上形成糖胺结构。有一类粘度很高的糖蛋白现称为蛋白聚糖(旧称粘蛋白)和糖蛋白的差别在于碳水化合物的含量不同。蛋白聚糖的含糖量可达50%左右。 (4)脂蛋白和蛋白脂。在脂蛋白和蛋白脂分子中,蛋白质部分和脂类以非共价键的形式相结合。某些脂蛋白中,脂类可能被包裹于蛋白质肽链的网状结构之中,因此只有肽链伸展后,才能出现脂质的反应。血清中α、β-球蛋白成分中的脂蛋白能溶于水,但不溶于有机溶剂。脑组织中的某些脂蛋白由于脂类含量高,能溶于有机溶剂,因此被称为蛋白脂。脂蛋白因含有脂类成分,所以密度低,脂蛋白本身通常还分为低密度、高密度和乳糜微粒 3种。脂蛋白存在于一系列生物组织和细胞器中,特别是细胞的各类膜结构中。 (5)金属蛋白质。许多蛋白质都含有极微量的金属离子。但有些蛋白质的金属离子含量相当高,蛋白质的功能与这些离子有重要的关系。如固氮酶系中的铁钼蛋白、血浆中的铜蓝蛋白、铁传递蛋白和铁蛋白等。 (6)血红素蛋白。含血红素辅基的蛋白质,血红素是一种铁卟啉复合物,与铁原子结合非常牢固。血红蛋白和肌红蛋白、细胞色素等都是血红素蛋白。它们的主要功能是运输或贮存氧,或传递电子。 (7)色蛋白。含有色素辅基的蛋白质。如黑素是一种色蛋白,存在于黑素瘤中,但目前对其结构了解甚少。胆绿蛋白存在于昆虫、红藻及蓝绿藻中,是一种胆绿素的衍生物,其分子量约270000。 生物功能分类可粗分为活性蛋白质和非活性蛋白质两类。 分离纯化主要利用一种蛋白质和其他物质之间的物理的、化学的以及生物学方面的不同特性来实现。这些特性包括蛋白质的溶解度、分子形状和分子大小、电离性质以及不同的生物功能等。 利用溶解度不同利用蛋白质在不同盐浓度、不同种类或不同浓度的有机溶剂、不同的pH值时溶解度不同的性质而达到蛋白质的分离纯化的目的。通常使用的中性盐沉淀称盐析法。最常用的盐是硫酸铵,最常用的有机溶剂是酒精和丙酮。 利用蛋白质分子形状和大小不同蛋白质的分子量可以从5000左右开始一直到数百万。由于所有蛋白质的元素组成相似,因而分子量大的蛋白质,其体积也比较大。利用这一差别来分离蛋白质的方法包括分子筛、超过滤及超速离心等技术。 利用蛋白质电离性质不同蛋白质的可电离基团有羧基、氨基、咪唑基、胍基和酚基等。蛋白质在不同pH下的带电情况是这些可电离基团电离情况的总结果,在不同的酸碱度时,它们的电离情况不同。在某一酸碱度时,某一蛋白质所带的正电荷和负电荷正好相等,这一酸碱度就是这一蛋白质的等电点,大部分球状蛋白质在等电点时的溶解度也非常小。由于电离基团的组成以及它们在分子中暴露情况不同,在一定条件下各种蛋白质的带电情况是不同的,这就是利用蛋白质的电离性质不同而达到分离目的的重要依据。 利用蛋白质带电性质的不同的分离方法主要有电泳及离子交换层析两类。 利用生物功能专一性──亲和层析法很多蛋白质有专一的生物功能,并常通过与其他蛋白质或小分子(称为配体)特异而非共价的结合来发挥功能,例如酶和底物或抑制剂,抗原和抗体,激素和受体等。亲和层析的基本原理是把待提纯的某一蛋白质的配体,通过适当的化学反应共价地结合到琼脂糖一类的多糖颗粒表面的官能团上,当含有待提纯的蛋白质混合样品加到这种多糖材料的层析柱上时,待提纯的蛋白质与其特异的配体相结合,因而被“吸附”在配体的载体──琼脂糖颗粒的表面,而这类多糖颗粒在其他性能方面则允许不与配体特异结合的蛋白质或其他的物质自由通过,因而可以把欲提纯的蛋白质和其他物质分开。 结构蛋白质具有十分复杂的结构。这种复杂性与生物分子有序性的高度统一,集中反映在蛋白质分子的结构具有丰富的层次。 1952年林诺斯特伦-朗首次使用一、二、三级结构的名称来粗略划分蛋白质分子的化学和空间结构。后来在三级结构以上又发展了四级结构,而且对上述各级结构的划分已有较为精确的定义,其中一级结构属于共价键结构,二级以上都属于空间结构。一级结构是其他各级结构的基础,蛋白质一级结构决定其高级结构特征,这是分子生物学中的一条基本规律。 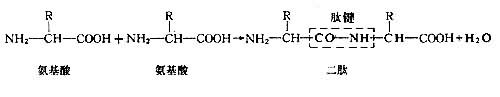
肽键和肽链在构成蛋白质时,氨基酸以肽键顺序相连。 这样的产物称为肽;组成肽的相当于氨基酸的部分称为氨基酸残基。多个氨基酸可以这一方式顺序结合成一链状分子,称为多肽链或肽链(见图)。图中示一条多肽链的一段。一般蛋白质分子都由大量氨基酸构成,所以,蛋白质就是具有特定空间卷曲和折叠的多肽链。 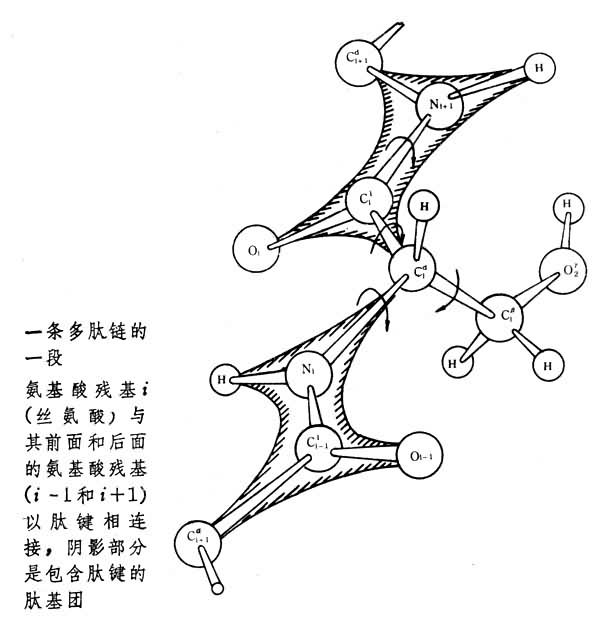
多肽链的共价主链形式上都是单键,因而-C-C-和-C-N-单键均应可自由旋转,但实际上,一个蛋白质的肽链在正常温度和pH的条件下具有一定的立体结构即构象,从而保证了蛋白质的生物活性。其原因是: (1)多肽链中的肽键 (2)肽键中的 C-N键的键长为1.32埃,比一般C-N单键(1.49埃)短,而比双键C=N(1.27埃)长,因此具有部分双键的性质,不能旋转。 (3)与C-N键相连的氢和氧原子的位置是反式的。根据上述肽键的空间结构原则,可以认为,一个肽键单位 蛋白质分子有的仅含一条多肽链,有的含有两条或多条多肽链,它们彼此以特定的方式 (共价或非共价)相互作用构成一个结构和功能的整体。 例如胰岛素是由A、B两条肽链组成,A、B链间由二对二硫键彼此连接,如将A、B链分离,胰岛素分子就完全受到破坏。有些多链蛋白质分子,其组成肽链可作为独立的结构单位,在完整的蛋白质分子内,它们彼此以非共价键相连接,而在被分离开来以后,又能保持其在完整分子内的共价键结构。这样的相对独立的肽链称为蛋白质的亚基。分离的亚基一般不再具有蛋白质完整分子的生物功能。由数量不多的亚基构成的蛋白质分子,也被称为寡聚体。 一级结构组成蛋白质分子的多肽链中氨基酸残基的排列顺序。蛋白质分子的一级结构通式如下: 
一级结构是蛋白质化学结构中最重要的内容,但完整的蛋白质化学结构,一般还包括: (1)多肽链的数目; (2)链间和链内的二硫键数目和位置; (3)与蛋白质分子共价结合的其他成分。 二级结构指肽链主链原子的局部空间排布,不包括与其他肽链的相互关系以及侧链构象的内容,所以二级结构仅涉及蛋白质分子主链的构象。已观察到的蛋白质二级结构有下列 3种类型: (1)螺旋。最常见的是α-螺旋,除极个别例外,全部是右手螺旋; (2)β-折叠层。分平行式和反平行式两种; (3)β-转角或称β-回折。由4个氨基酸残基以第1和第4个残基间形成氢键稳定的三肽构象,这类构象可使肽链产生180°的转折,所以对蛋白质分子复杂而多样的三维折叠具有重要作用。此外在蛋白质分子中还有一些肽段不具有一定的有序的立体结构,通常称为无规则卷曲肽段。 在所有已测定的蛋白质结构中,都有广泛的二级结构存在,但在不同种类的蛋白质中,二级结构的分布和作用都很不一样。在纤维状蛋白质中,二级结构是分子的基本结构,并决定分子的一些基本特性,例如角蛋白主要由 α-螺旋构成,蚕丝的丝心蛋白主要由β-折叠层构成,胶原是由3股左手螺旋构成。在球状蛋白质中,二级结构是分子三维折叠的基本要素,对分子的骨架形成具有重要作用,但整个分子的错综复杂的三维特征更多地依赖于侧链的相互作用和除氢键以外的其他作用力, 在大多数球状蛋白质分子中,兼有各种二级结构,彼此并无一定的比例。 三级结构指蛋白质分子或亚基内所有原子的空间排布,但不包括亚基间或分子间的空间排列关系。可以理解为蛋白质分子内的肽链在二级结构的基础上(包括无规卷曲线团)在三维空间进一步折叠,盘曲形成包括蛋白质分子主链和侧链全部在内的专一性三维排布。可以说,所有具有重要生物功能的蛋白质都有严格的特定的三级结构。 蛋白质分子复杂的立体结构,是依靠复杂的作用力体系来稳定的,共价键和次级键均起重要的作用,如二硫键、氢键、疏水键、离子和范德华键,其中次级键占重要地位。 四级结构指蛋白质亚基的立体排布,亚基间的相互作用与接触部位的布局,但不包括亚基内部的空间结构。多亚基蛋白质中亚基的数目、类型、亚基间的空间排布、亚基间的相互作用和接触部位的布局等都是蛋白质四级结构的范畴。 在寡聚体中的蛋白质亚基,有完全相同的,也有不同的。如过氧化物酶由4个相同的亚基构成,而血红蛋白分子则是由两种亚基 (α和β)各一对组成。四级结构对蛋白质的功能具有重要意义。 蛋白质结构和功能的关系变性和复性蛋白质分子在受到外界的一些物理和化学因素的影响后,分子的肽链虽不裂解,但其天然的本体结构遭致改变和破坏,从而导致蛋白质生物活性的丧失和其他的物理、化学性质的变化,这一现象称为蛋白质的变性。早在1931年中国生物化学家吴宪就首次提出了正确的变性作用理论。 引起蛋白质变性的主要因素有: (1)温度。许多溶液中的蛋白质在温度升高至50~60℃以上时,就会变性。热变性常引起蛋白质的聚合和沉淀,一般难于复性; (2)酸碱度。蛋白质溶液的过高或过低的pH值均会破坏蛋白质结构的稳定性,从而导致变性; (3)有机溶剂。通过影响蛋白质分子内的静电力,氢键和疏水作用,有机溶剂常诱导蛋白质的变性; (4)脲和盐酸胍。这是应用最广泛的蛋白质变性试剂。一般认为,这类试剂的变性作用在于它们使蛋白质分子内部的疏水基团暴露于溶剂中; (5)去垢剂和芳香环化合物。去垢剂如十二烷基硫酸钠 (SDS)很易引起多亚基蛋白质解离为单亚基蛋白质和亚基的变性。一些多环化合物,如蒽和菲,也都能引起蛋白质的变性。 蛋白质的变性有很大的范围,可以是少数侧链取向的改变,也可以是所有原子的空间位置都发生显著变化。蛋白质的变性常伴随有下列现象: (1)生物活性的丧失。蛋白质的生物活性是指其所具有的酶、激素、毒素、抗体等专一的活性以及其他的特殊性质,如血红蛋白的载氧能力,肌球蛋白和肌动蛋白相互结合的能力等。当蛋白质发生变性时,生物活性就会部分或全部丧失,这是蛋白质变性的最主要特征; (2)化学性质的改变。表现在一些侧链基团的暴露。蛋白质在变性时,由于肽链的伸展,使得有些原来隐藏在分子内部而不易与化学试剂起反应的侧链活性基团暴露出来,如半胱氨酸中的SH基,酪氨酸中的苯酚基等。化学性质的改变还表现在蛋白质变性后,易为蛋白酶所水解,水解部位增多,被水解的速度有很大的提高; (3)物理性质的改变。大多数天然的球状蛋白质均可结晶,但变性后即失去结晶能力。蛋白质变性后,溶解度降低。肽链的伸展使分子的不对称程度提高,这往往导致粘度增加,扩散系数降低,旋光值改变以及出现流动双折射等一系列物理性质的变化。 在变性因素去除以后,变性的蛋白质分子又可重新回复到变性前的天然的构象,这一现象称为蛋白质的复性。蛋白质的复性有完全复性、基本复性或部分复性。只有少数蛋白质在严重变性以后,能够完全复性。一般认为,大多数蛋白质不能完全复性的原因在于变性态可能处在一个非天然的亚稳态,或者由于天然结构本身可能在热力学上就不是一个总体能量最低的状态。 蛋白质变性和复性的研究,对了解体内体外的蛋白质分子的折叠过程十分重要。主要通过蛋白质的变性和复性的研究,肯定了蛋白质折叠的自发性,证实了蛋白质分子的特征三维结构仅仅决定于它的氨基酸序列。在这方面作出重要贡献的典型研究实例是美国C.B.安芬森小组关于牛胰核糖核酸酶的变性和复性的研究。牛胰核糖核酸酶含有124个氨基酸残基,由8个巯基配对组成4对二硫键。可以计算出酶分子中8个巯基组成4对二硫键的可能方式有105种,这就提供了一个定量估算复性重组的指标。在温和的碱性条件下,8摩尔的浓脲和大量巯基乙醇能使四对二硫键完全还原,整个分子变为无规则卷曲状,酶分子变性。透析去除脲,在氧的存在下,二硫键重新形成,酶分子完全复性,二硫键中成对的巯基都与天然一样,复性分子可以结晶且具有与天然酶晶体相同的X射线衍射花样,从而证实,酶分子在复性过程中,不仅能自发地重新折叠,而且只选择了105种二硫键可能配对方式中的一种。 蛋白质的激活活性蛋白质分子在生物体内刚合成时,常常不呈现活性,即不具有这一蛋白质的特定的生物功能。要使蛋白质呈现其生物活性,一个非常普遍的现象是,蛋白质分子的肽链在一些生化过程中必须按特定的方式断裂。例如许多酶有一个不具有活性的前体,称为酶原。酶原经过专一的蛋白水解酶的作用,将某一特定的肽链断裂,切去一段或几段肽链以后,变成有活性的酶,使无活性的酶原变成有活性的酶的过程称为酶原的激活作用。此外,许多蛋白质激素也有前体。如胰岛素原,在A链N端与B链C端之间有一段C肽,经专一的酶水解而释放出C肽,变成胰岛素。 蛋白质的激活是生物的一种调控方式,这类现象在各种重要的生命活动中广泛存在,如血纤维蛋白原到血纤维蛋白的转化;又如在噬菌体的外壳蛋白的装配过程中,也有大量的前体肽链断裂的情况。 亚基的调节很多蛋白质由亚基组成,这类蛋白质在完成其生物功能时,在效率和反应速度的调节方面,很大程度上依赖于亚基之间的相互关系。如血红蛋白和肌红蛋白在不同的组织中都结合氧,但前者输氧后者贮存氧,任务不同。从结构上看肌红蛋白仅有一条肽链,而血 红蛋白有四条以非共价键结合的肽链 (两条α-链和两条β-链),即有4个亚基。尽管血红蛋白的亚基和肌红蛋白肽链在一级、二级、三级结构方面很相似,但由于血红蛋白有四级结构,因此血红蛋白和肌红蛋白的氧结合曲线有很大不同,血红蛋白为S形曲线,肌红蛋白为双曲线,这是由于血红蛋白分子对氧的结合是 4个亚基协同作用的结果。当第一个α-亚基和氧结合时,其立体结构发生改变,通过亚基之间的相互作用,引起其余亚基的立体结构的变化,从而提高其余亚基对氧的亲和力,这种现象也称为别构效应。 亚基参与蛋白质功能的调节是一个相当普遍的现象,特别在调节酶的催化功能方面。有些酶存在和活性部位不重叠的别构部位,别构部位和别构配体相结合后,引起酶分子立体结构的变化,从而导致活性部位立体结构的改变,这种改变可能增进,也可能钝化酶的催化能力。这样的酶称为别构酶。已知的别构酶在结构上都有两个或两个以上的亚基。例如天冬氨酸转氨甲酰酶是一个具有6个催化亚基和6个调节亚基的12聚体。胞嘧啶核苷三磷酸是这一酶的别构配体,它能首先和酶的调节亚基相结合,引起调节亚基立体结构的变化,这一变化传导至催化亚基,导致酶的催化活力降低。 功能催化功能有催化功能的蛋白质称酶,生物体新陈代谢的全部化学反应都是由酶催化来完成的,器官的分化、肿瘤细胞的转化等也和酶的活动有关。 运动功能从最低等的细菌鞭毛运动到高等动物的肌肉收缩都是通过蛋白质实现的。肌肉的松弛与收缩主要是由以肌球蛋白为主要成分的粗丝以及以肌动蛋白为主要成分的细丝相互滑动来完成的。这一过程中还有很多具有调节功能的蛋白质参加。自60年代始相继发现在很多植物以及原生生物中也有运动蛋白。其中有一些与肌肉收缩蛋白相似,也有一些是完全不同的,如微管蛋白、鞭毛蛋白等。 运输功能在生命活动过程中,许多小分子及离子的运输是由各种专一的蛋白质来完成的,例如在血液中,血浆白蛋白运送小分子、红细胞中的血红蛋白运送氧气和二氧化碳等。 机械支持和保护功能高等动物的具有机械支持功能的组织如骨、结缔组织以及具有覆盖保护功能的毛发、皮肤、指甲等组织主要是由胶原、角蛋白、弹性蛋白等组成。 免疫和防御功能生物体为了维持自身的生存,拥有多种类型的防御手段,其中不少是靠蛋白质来执行的。例如抗体即是一类高度专一的蛋白质,它能识别和结合侵入生物体的外来物质,如异体蛋白质、病毒和细菌等,取消其有害作用。 调节功能在维持生物体正常的生命活动中,代谢机能的调节,生长发育和分化的控制,生殖机能的调节以及物种的延续等各种过程中,多肽和蛋白质激素起着极为重要的作用。此外,尚有接受和传递调节信息的蛋白质,如各种激素的受体蛋白等。 蛋白质作为生命活动中起重要作用的生物大分子,与一切揭开生命奥秘的重大研究课题都有密切的关系。蛋白质是人类和其他动物的主要食物成分,高蛋白膳食是人民生活水平提高的重要标志之一。许多纯的蛋白质制剂也是有效的药物,例如胰岛素、人丙种球蛋白和一些酶制剂等。在临床检验方面,测定有关酶的活力和某些蛋白质的变化可以作为一些疾病临床诊断的指标,例如乳酸脱氢酶同工酶的鉴定可以用作心肌梗塞的指标,甲胎蛋白的升高可以作为早期肝癌病变的指标等。在工业生产上,某些蛋白质是食品工业及轻工业的重要原料,如羊毛和蚕丝都是蛋白质,皮革是经过处理的胶原蛋白。在制革、制药、缫丝等工业部门应用各种酶制剂后,可以提高生产效率和产品质量。蛋白质在农业、畜牧业、水产养殖业方面的重要性,也是显而易见的。
|

 中的四个原子和它的相邻的两个 α-碳原子都处于同一个平面上。
中的四个原子和它的相邻的两个 α-碳原子都处于同一个平面上。


















