偏摩尔热力学函数
|
[拼音]:pianmo’er relixue hanshu [外文]:partial molar thermodynamic function 对于一个多组分均相系统,偏摩尔热力学函数XB定义为:
XB称为在该系统中物质B的偏摩尔热力学函数。式中X为系统中的某一广延量(如体积、焓、熵等),nB为系统中物质B的物质的量,偏微分 多组分均相系统的任一广延量均有其相应的偏摩尔热力学函数,例如 系统的偏摩尔热力学函数是强度量,其数值取决于系统的温度、压力和组成,而与系统内物质的总量无关。 在多组分均相系统中,系统内任一广延量的数值取决于系统的温度、压力及系统中各组分的物质的量,因此广延量X的全微分表达式可写为:
在系统的温度、压力及组成不变的条件下对式(2)积分,可得:
式(3)称为偏摩尔热力学函数的集合公式。此式表明,系统的某一广延量的数值等于系统中各物质的物质的量与其相应的偏摩尔热力学函数的乘积之和。 将式(3)取全微分并与式(2)相比较,可得:
在等温等压条件下,式(4)变为:
式(4)和(5)都称为吉布斯-杜亥姆方程,它是由J.W.吉布斯和P.杜亥姆分别于1875年和1876年提出的。 在偏摩尔热力学函数中,偏摩尔吉布斯函数是最有用的,它又称为化学势,用符号μB表示,其定义为:
式中G为系统的吉布斯函数。将式(2)中X换成G,可得:
将式(7)与封闭系统的热力学函数基本关系式:dG=-SdT+Vdp相比较,可得:
此式即为组成可变系统的热力学函数基本关系式。式中 如果系统经历一个等温等压变化,则式(8)成为:
若该系统为封闭系统,且在上述变化中没有非体积功,则根据吉布斯函数判断过程方向的依据,当 将上述结论用于相变过程和化学反应过程,可以得到以下推论: (1)在一个多相系统中,物质总要从化学势高的相自动地向化学势低的相转移。当系统中的每一种物质在各相中的化学势相等时(即 (2)若一个多组分系统中的化学反应符合下述条件:
式中B为参加反应的化学物质;vB为物质B的化学计量数,反应物取负值,产物取正值,则当
化学势随温度及压力变化的关系,可用下列关系式表示:
式(12)~(14)中的VB、SB、HB分别为系统中物质B的偏摩尔体积、偏摩尔熵和偏摩尔焓。 |

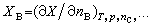 (1)
(1)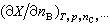 表示在系统的温度T、压力p及除物质B外其他组分的物质的量nC都不改变的条件下,系统的某一广延量X随物质B的物质的量变化的变化率。
表示在系统的温度T、压力p及除物质B外其他组分的物质的量nC都不改变的条件下,系统的某一广延量X随物质B的物质的量变化的变化率。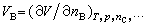 称为物质B的偏摩尔体积;
称为物质B的偏摩尔体积;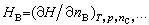 称为物质B的偏摩尔焓;
称为物质B的偏摩尔焓;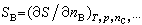 称为物质B的偏摩尔熵。
称为物质B的偏摩尔熵。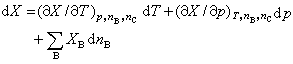 (2)
(2)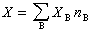 (3)
(3)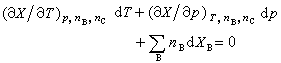 (4)
(4)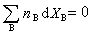 (5)
(5)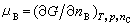 (6)
(6)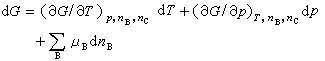 (7)
(7)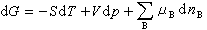 (8)
(8)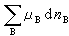 项代表当系统中的某些物质的物质的量发生变化时所引起系统吉布斯函数的变化。
项代表当系统中的某些物质的物质的量发生变化时所引起系统吉布斯函数的变化。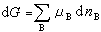 (9)
(9)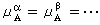 ,
,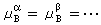 ,
,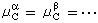 ,式中角标A、B、C、…为不同的物质;α、β、…为不同的相),系统达到相平衡。
,式中角标A、B、C、…为不同的物质;α、β、…为不同的相),系统达到相平衡。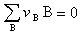 (10)
(10)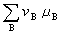 <0时,反应能自动地正向进行。系统达到化学平衡时,则符合:
<0时,反应能自动地正向进行。系统达到化学平衡时,则符合: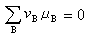 (11)
(11)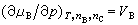 (12)
(12)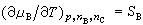 (13)
(13)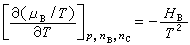 (14)
(14)

















