离子溶液的粘度
|
[拼音]:lizi rongye de niandu [外文]:viscosity of ionic solution 由于液体的流动,每个分子必定偏离平衡位置,所以粘度与分子的相对位置(即结构)有密切关系,因此研究溶剂和溶液的粘度就能提供溶液结构的信息。 液体的粘滞系数常称为粘度,用η表示。设在流动的液体中,平行于流动方向将流体分成不同流动速度的各层,则在任何相邻两层的接触面上就有与平面平行而与流动方向相反的阻力,它称为粘滞力。如果相距为1厘米的两层,其速度差为1厘米/秒,则作用于1厘米2面积上的粘滞力为流体的粘滞系数。 在相同条件下,溶液的粘度η与纯溶剂的粘度η0之比η/η0称相对粘度ηr。溶液和溶剂粘度的差与纯溶剂粘度之比(η-η0)/η0=ηr-1=ηsp称为增比粘度。粘度的倒数称为流度φ。 电解质溶液的粘度由于存在对溶剂结构有重要影响的电解质,溶剂的粘度会发生较大的变化。溶液的粘度与电解质的体积摩尔浓度c的关系可用琼斯-多尔方程表示: η=η0(1+Ac1/2+Bc) 式中系数A由离子-离子相互作用的静电场决定: 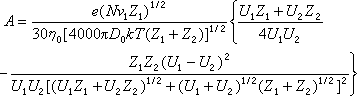
式中U1、U2为具有离子价Z1、Z2(Z1>Z2)的离子绝对淌度(见离子淌度);v1为由 1摩尔电解质形成第一类离子的数目;D0为溶剂的介电常数;k为玻耳兹曼常数;N为阿伏伽德罗数,e为电子的电荷。系数B与离子和溶剂相互作用有关,每个离子的贡献是独立的,并具有加和性。 当溶剂中离子发生缔合时,琼斯-多尔方程变为: η=η0[1+A(cα)1/2+Bcα+B′c(1-α)] 式中B和B′分别为自由离子和离子对的琼斯-多尔系数,α为施加电场影响下离子自由移动(离解)的部分。 离子对溶剂粘度的影响主要表现在离子-离子和离子-溶剂的相互作用上,后者通过在离子溶剂化壳层中束缚一些溶剂和离子对溶剂结构性质的更长距离的效应来影响粘度。琼斯-多尔方程中的系数B归因于离子-溶剂的相互作用,在较高浓度下比较突出,可用图 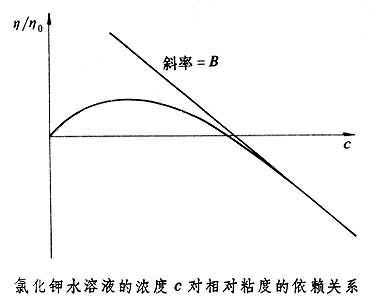
中氯化钾水溶液浓度对粘度的依赖关系来说明。 具有二价离子的盐类,如硫酸镁等,可使水溶液的粘度显著增加。影响水的结构的离子(如Mg 在获得盐的B值后,将它们分成单个离子的B′值,例如在碘酸锂水溶液中,把Li+看作比IO婣的淌度略大一些(约3%)。假设水化Li+和IO婣有相似的体积,用斯托克斯定律可知Li+的B应比IO婣的大10%(约32%),便可给出 表1说明,在相同的溶剂中,B值随离子半径的增大而减小,这是由于离子半径增加时,正离子和水分子间的取向力减弱,水分子在离子附近定向区减少,水的结构被破坏。同种离子在不同溶剂中的B值不同(表2)。 
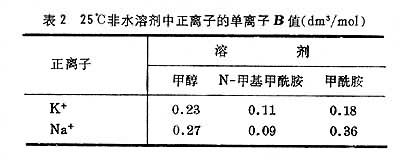
为了进行比较,通常保持相同的负离子,找出不同正离子系数B的差值ΔB,例如在25℃水溶液中正离子对单离子B值之间的 对单离子B值和ΔB值的讨论主要根据正离子对溶剂结构的影响。在水中对结构破坏者的B值是负的,对结构的形成者的B值是正的。在甲醇中所有的B值都是正的,因为结构破坏很少,所以溶剂的粘度是难以减小的。综上所述,由B值主要可以判断定性的溶剂化趋势和离子对溶剂结构性质的影响。 浓溶液的粘度研究从 1Μ到饱和溶液的粘度与温度的依赖关系的工作有苏瑞安纳雷扬纳-文卡特森经验方程: η=η0exp(bcp) 式中b是与溶质特性有关的常数;cp为同温下任何给定浓度时溶质的摩尔分数对饱和浓度时溶质的摩尔分数的比率。作者还提出了溶液的粘度等输运性质由它的内压决定。
|

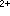 )称为结构形成的离子,其B值是正的;而结构破坏的离子(如Cs+)的B值是负的。
)称为结构形成的离子,其B值是正的;而结构破坏的离子(如Cs+)的B值是负的。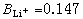 和
和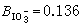 的估计值。又如氯化钾的B值为-0.014,这是由于K+和Cl-的细小相等效应,
的估计值。又如氯化钾的B值为-0.014,这是由于K+和Cl-的细小相等效应,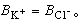
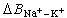 为0.093;在甲醇溶液中为0.003;在甲替甲酰胺中为-0.016。
为0.093;在甲醇溶液中为0.003;在甲替甲酰胺中为-0.016。


















