光化学定律
|
[拼音]:guanghuaxue dinglü [外文]:laws of photochemistry 1818年C.J.D.格罗特斯等人曾提出光化学活化原则:只有被物质吸收的光,才能产生光化学变化。这就是光化学第一定律。因而,不仅应该知道反应的吸收光谱和光源的光谱能量分布,而且也应了解光源与反应物间存在的溶剂、产物和玻璃制品的吸收光谱。 一般,参与光化学反应的物质并没有吸收全部的入射光能。光子的吸收几率关系到入射的光辐射能否改变基态分子的电子分布,以达到特定的激发态。根据朗伯-比尔定律: 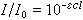
式中I0为入射到单吸收组分样品池前面的严格单色光的强度;I为经程长为 l的样品池后的出射光强;c为吸光物质的浓度;ε为摩尔消光系统,它与吸收几率有直接关系。当有多种组分的吸收物质均匀混合时,朗伯-比尔定律可表示为: 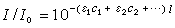
1908年J.斯塔克和1912年A.爱因斯坦把能量的量子概念应用到分子的光化学反应上,他们提出了量子活化原则:分子的光吸收是单量子(光子)过程,在初始光化学过程中活化一个分子,所以初始过程的量子产额之和应为 1。这就是光化学第二定律。在常规光化学系统中,属低光强照射,被吸收光子数为1013~1015厘米-3·秒-1。由于激发态分子的寿命很短,处于电子激发态的分子也只能有很低的浓度,所以第二光子的吸收几率极小。在高光强照射条件下,例如在闪光光解和某些激光光化学实验中被吸收光子数为1018厘米-3·秒-1以上,在高光子密度的光化学反应中有时会发生双光子吸收。 光反应的量子产率φ定义为: 
而且是根据单色光测量的。在通常的光化学反应中,φ ≤1。例如φ>1,则是借光化学过程使某种反应物分子产生了链反应。例如在碳氢化合物的光氯化反应中即发生了借光引发的若干非光化学的链式反应。 |
热门点击
最近更新




















