气体分子的平均自由程
|
[拼音]:qiti fenzi de pingjun ziyoucheng [外文]:mean free path of gas molecules 气体分子相继两次碰撞间所走路程的平均值。在气体分子的碰撞理论的刚球模型中,认为分子只在碰撞的一刹那发生相互作用,而在其他时间内,分子作直线运动。相继两次碰撞间所走的路程叫分子的自由程。由于气体分子的数目很大,碰撞频繁,运动的变化剧烈,故其自由程只有统计意义。以速率v运动的分子,在dt时间内走过υdt的路程,受到碰撞的可几次数是 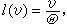
由此得到的自由程与分子的速度有关,对各种速度求平均,就得到平均自由程。用平衡态的麦克斯韦分布求出的平均自由程有两种。 (1)麦克斯韦平均自由程 l。规定为气体分子的平均速度 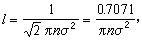
式中n为分子的数密度,σ为分子的半径。 (2)泰特平均自由程lT。规定为气体分子的速度与碰撞频率之比的平均为lT=<v/ 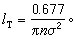
1857年还未发现气体分子的速度分布律,R.克劳修斯假定气体分子的速率相同而方向不同,最先引入了自由程的概念。克劳修斯的自由程lC为 通常所说的平均自由程是麦克斯韦平均自由程。利用理想气体状态方程P=nnT,可将平均自由程的公式换成温度T 和压强P的函数 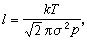
式中n是玻耳兹曼常数。 标准状态下,空气分子的有效直径为 3.5×10-10m,平均分子量为29,利用上述公式算出其平均自由程为l=6.9×10-8m。可见,在标准状态下,空气分子的平均自由程约为其有效直径的200倍。 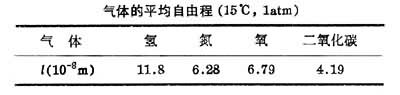
在气体输运的初级理论和真空技术、气体放电等领域中,平均自由程都是常用的重要物理量。 |
热门点击
最近更新

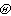 dt,
dt,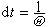 。自由程l(υ)为
。自由程l(υ)为 与平均碰撞频率
与平均碰撞频率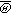 之比
之比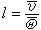 。如此得到的平均自由程为
。如此得到的平均自由程为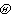 >。如此算得的平均自由程为
>。如此算得的平均自由程为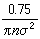 。
。


















