质量作用定律
|
[拼音]:zhiliang zuoyong dinglü [外文]:law of mass action 理想气体混合物在恒温恒压下进行化学反应达到平衡状态时,参加反应的每一种气体的分压强p0i或浓度C0i与系统的压强和温度间应满足的关系。由挪威化学家C.M.古尔德贝格和P.瓦格根据化学反应的速率与参加反应的活性质量(就是指分压强或浓度或摩尔分数)成正比的关系于1867年提出的。其数学表达式为 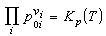
或 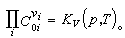
以上二式中左端的∏表示连乘,v 是正或负的整数;右端的Kp和KV分别称为定压平衡常数和定容平衡常数,Kp仅是温度的函数,而K V则是温度和压强的函数,与参加反应的各种气体的初始含量无关(见化学热力学),Kp与K V的关系为 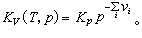
质量作用定律不仅适用于气体,也适用于稀溶液。如果除了气体和稀溶液以外,还有纯固体参加反应,则因为纯相的化学势只依赖于温度和压强,故在前二式的左端并不包含有关纯相的因子,仍然只需写出气体(或溶质)的分压强或浓度的乘积即可,就好像固体根本不存在一样。事实上,固体的存在只影响平衡常数对温度和压强的依赖关系。 根据质量作用定律,可以确定化学反应中各反应物和生成物的活性质量之间的联系。它在化学平衡学说中具有重要的意义。 |
热门点击
最近更新




















