水解
|
[拼音]:shuijie [外文]:hydrolysis 物质与水发生的复分解反应。由弱酸根或弱碱离子组成的盐类的水解有两种情况: (1)弱酸根与水中的H+结合成弱酸,溶液呈碱性,如乙酸钠的水溶液: 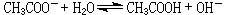
(2)弱碱离子与水中OH-结合,溶液呈酸性,如氯化铵水溶液: 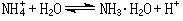
生成弱酸(或碱)的酸(或碱)性愈弱,则弱酸根(或弱碱离子)的水解倾向愈强。例如,硼酸钠的水解倾向强于乙酸钠,溶液浓度相同时,前者的pH更大。 弱酸弱碱盐溶液的酸碱性取决于弱酸根和弱碱离子水解倾向的强弱。例如,碳酸氢铵中弱酸根的水解倾向比弱碱离子强,溶液呈碱性;氟化铵中弱碱离子的水解倾向强,溶液呈酸性。若两者的水解倾向相同,则溶液呈中性,这是个别情况,如乙酸铵。 弱酸弱碱盐的水解与相应强酸弱碱盐或强碱弱酸盐的水解相比,弱酸弱碱盐的水解度大,溶液的pH更接近7(常温下)。如0.10摩/升的Na2CO3的水解度为4.2%,pH为11.6,而同一浓度的(NH4)2CO3的水解度为92%,pH为9.3。 酯、多糖、蛋白质等与水作用生成较简单的物质,也是水解: CH3COOC2H5+H2O─→CH3COOH+C2H5OH (C6H10O5)n+nH2O─→nC6H12O6 某些能水解的盐被当作酸(如硫酸铝)或碱(如碳酸钠)来使用。 |
热门点击
最近更新




















