生物大分子衍射技术
|
[拼音]:shengwu dafenzi yanshe jishu [外文]:diffraction techniques of biological macromolecules 从衍射花样(衍射线的方向和强度)推算生物大分子的三维结构(也常称空间结构、立体结构或构象)的技术。其主要原理是 X射线、中子束或电子束通过生物大分子有序排列的晶体或纤维所产生的衍射花样与样品中原子的排布规律有可相互转换的关系(互为傅立叶变换)。 X 射线衍射技术能够精确测定原子在晶体中的空间位置,是迄今研究生物大分子结构的主要技术。中子衍射和电子衍射技术则用来弥补X射线衍射技术之不足。生物大分子单晶体的X射线衍射技术是50年代以后,首先从蛋白质的晶体结构研究中发展起来的,并于70年代形成一门晶体学的分支学科──蛋白质晶体学。生物大分子单晶体的中子衍射技术用于测定生物大分子中氢原子的位置,也属蛋白质晶体学。纤维状生物大分子的X射线衍射技术用来测定这类大分子的一些周期性结构,如螺旋结构等。以电子衍射为原理的电子显微镜技术能够测定生物大分子的大小、形状及亚基排列的二维图象。它与光学衍射和滤波技术结合而成的三维重构技术能够直接显示生物大分子低分辨率的三维结构。 历史回顾1912年德国物理学家 M.von劳厄预言晶体是 X射线的天然衍射光栅。此后英国物理学家W.H.布喇格和W.L.布喇格开创了X射线晶体学。几十年来,这门学科不断发展和完善,测定了成千上万个无机和有机化合物的晶体和分子结构。由它提供的结构资料已经成为近代结构化学的基础。但是传统的小分子晶体结构的分析方法不适用于原子数目多,结构复杂的生物大分子。直到1954年英国晶体学家M.F.佩鲁茨等人提出在蛋白质晶体中引入重原子的同晶置换法之后,才有可能测定生物大分子的晶体结构。1960年英国晶体学家J.C.肯德鲁等人首次解出一个由153个氨基酸组成、分子量为17500的蛋白质分子──肌红蛋白的三维结构。图1 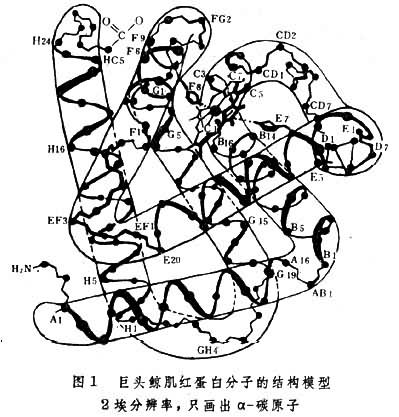
表示它的 2埃分辨率的结构模型。此后生物大分子晶体结构的研究工作迅速发展。至80年代初,已有近 200个蛋白质、核酸等生物大分子的三维结构被测定,从而有力地推动了分子生物学的发展。中国继60年代首次人工合成牛胰岛素之后,于70年代初测定了三方二锌猪胰岛素的三维结构。1986年中国已经完成这个结构1.2埃高分辨率的修正工作。 晶体和X射线衍射电磁波是直线传播的,但在某些情况下也会拐弯,这就是衍射现象。当可见光通过针孔或狭缝时,就会出现这种现象。由于针孔或狭缝的大小和可见光的波长量级相同,可以把针孔或狭缝看做是一个点光源,它向四面八方辐射出二次电磁波,或称散射波。如果有多个有序排列的针孔或狭缝,由于这些散射波的干涉,就会形成规则的明暗相间的衍射花样。这是因为来自不同部位的散射波的相位及振幅不同,它们相加的结果在有些地方加强,而在另一些地方减弱。这些花样随波长或针孔的大小及其排布方式不同而变化(图2)。 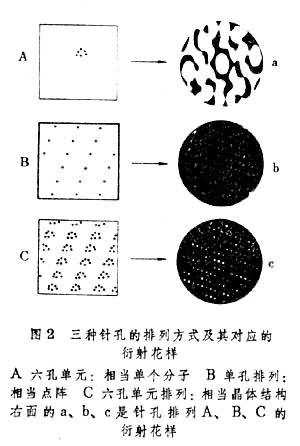
当X射线通过晶体时,晶体内原子的核外电子能够散射X射线。如果把每个原子看成是个散射源,由于X射线的波长同原子间的距离量级相同,因此也会发生衍射现象。晶体结构的特征是晶体内的原子或分子周期重复地排列。如果采用一组抽象的几何点来表示这种周期重复的规律,那么这种排列可以表示为点阵。晶体的三维点阵结构使得晶体可被划分成为无数个大小和形状完全相同的平行六面体,即被称为晶胞。它是晶体结构的基本重复单位。每个晶胞内包含种类、数目和排列完全相同的原子。可以推得,衍射线(也称反射线)的强度取决于晶胞的内容,它的方向取决于波长和晶胞的大小和形状。 晶体结构测定晶体对X射线、中子束及电子束的衍射,与规则排列的针孔对可见光的衍射遵循相同的光学变换原理,即针孔或晶体的结构(针孔或晶体中原子的排列)经傅里叶变换,可以得到它们的倒易图像──衍射波谱。反之,衍射波谱的反变换,即为正空间的图像──针孔的排列或晶体的结构。在可见光的衍射中,这种反变换可由透镜的聚焦过程实现。但是迄今为止,人们还未找到能使 X射线(或中子)散射线聚焦的办法。因此也就无法直接观察生物大分子的像。这只能借助电子计算机从数学上完成这种反变换的计算。它的计算式为 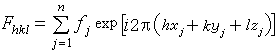
式中n指晶胞所含的原子数目,(xjyjzj)为原子j在晶胞中的坐标。实际上表达式中的被加项正是晶胞内各原子的散射波方程(已对时间平均)。其中ƒj为原子j 的散射波振幅(称为原子散射因子),它与原子种类有关。指数部分为该原子的散射波相对于晶胞原点散射的相位差。因此一个晶胞的结构因子即为晶胞内各原子的散射波叠加而成的复合波。它也可用复数形式表示: 
式中 目前确定生物大分子晶体晶胞衍射相位的方法已有几种,如同晶置换法,反常散射法及分子置换法等。其中同晶置换法可以普遍适用,其他方法根据情况选用。同晶置换法需要制备同晶型的重原子衍生物,即在不会改变分子和晶体结构的情况下,在晶体中引入一种较重的金属原子。这些金属原子在晶体中以和其他原子相同的周期重复规律排列。它们对于 X射线的散射仅影响晶体的衍射强度,而不改变衍射方向。这时重原子的结构振幅可由衍生物与天然晶体衍射强度的差值求得。由于晶体中引入重原子的数目有限,我们可以采用别的办法(例如帕特逊函数法)来确定它们的位置,进而可以计算重原子的结构因子。如果能有两个以上同晶型的衍生物,就可利用矢量三角形法则求得天然晶体的相位,因而也就可以解出这种晶体的结构。这种方法称为多对同晶置换法。当晶体中重原子的吸收边接近入射 X射线的波长时,重原子内层的约束电子对于入射线会有很强的散射作用,称为反常散射。此时晶体衍射强度的中心对称定律不再成立,即| 数据收集方法生物大分子衍射强度的收集方法主要有照相法和面积探测器法。前者是用底片收集衍射点,然后通过自动扫描微光密度计测量强度数据。后者是用面积探测器,它能一次同时记录一批衍射线的强度。这个方法具有兼顾测量的速度和精度,以及晶体定位方便的优点,因此已被广泛采用。普遍使用的X光源是旋转阳极X光发生器。应用强X射线源-同步回旋加速器辐射不仅能缩短收集数据的时间,提高数据质量,而且可以研究一些样品的动力学过程。同时还可充分利用反常散射效应改善获得相位信息的方法。 蛋白质晶体学的成就在晶体结构测定的早期阶段,人们首先看到的是α-螺旋,β-折叠层等二级结构在天然蛋白中的实际表现。随着更多的结构问世,人们逐渐地对于蛋白质中非成键原子间的弱相互作用有了更加透彻的了解,从而不断总结出一些结构规律。例如人们已可以对球蛋白的结构进行解析和分类。有人将这类蛋白质的结构单元分为几大类,即螺旋、β-结构、回折、凸包、硫桥、不重复结构、无序结构、水结构及结构域等。并对每一类的结构规律有了一定的了解(见蛋白质)。 目前,由晶体学所测定的蛋白质大致可以分为:酶、氧化还原蛋白、运载蛋白、贮存蛋白、激素、抗体、DNA结合蛋白、糖结合蛋白、肌肉蛋白、毒素膜蛋白等。这些晶体结构的测定揭示了结构与功能的紧密关系。例如溶菌酶的活性部位是个界限清楚的裂缝,而胰凝乳蛋白酶的活性部位是个深为10~12埃的口袋。这些结构特征都和它们的底物或抑制剂分子的性质、大小和形状有关。胰蛋白酶、弹性蛋白酶与胰凝乳蛋白酶具有十分相似的三维结构,它们结合底物或抑制剂特异性的差别仅由于活性部位的少数残基不同。在醇脱氢酶中,反应是通过活性部位上的锌结合水而起作用的。在大多数情况下,当底物与酶结合时,酶分子将发生构象变化,即所谓诱导契合。在某些情况下,一些催化基团可移动相当距离。血红蛋白是一类运载蛋白,在血液中担负输氧的任务。晶体结构的测定阐明了它的别构效应。其他由 4个相同的亚基配对组成。每个亚基都含一个铁原子,它们位于各个血红素的中心。晶体结构测定表明这些血红素处于蛋白表面的疏水袋中。这个低介电常数的环境使得它们不易氧化而利于氧合。当第一个亚基发生氧合时,血红素上的铁原子相对卟啉环作微小的移动,同时铁原子的自旋态跃迁。这些变化被传递到分子的其他亚基上,并使它们的铁原子也与氧结合。这种构象上的协同变化称为别构效应,它是血红蛋白输氧的主要机制。胰岛素是一种激素蛋白。在它的晶体结构问世以前,人们对它的作用机理和部位了解甚少。70年代初,牛津小组和北京小组分别独立解出胰岛素的晶体结构,为胰岛素作用机理的研究开辟了广阔的前景。从结构模型上可以看到不同种属中保持不变的残基集中于某些部位。这些残基的化学修饰对于生物活性非常敏感。说明这些部位对于靶细胞膜表面胰岛素受体结合的重要性。光合作用是植物有效地将光能转换成化学能的过程。长期以来,人们曾以极大的努力研究它的原理,试图揭示它的奥秘。但是直到80年代,也是由于晶体学的成就才使这个研究领域取得突破性的进展。1985年由联邦德国晶体学家R.胡伯领导的研究组测定了一种绿色细菌光合反应中心蛋白质复合体的晶体结构,并阐明了光激发电子是如何在这复合体上产生、传递,从而通过细胞膜的。他们的成就不仅使得人们能在原子水平上认识光合作用的原初机制,而且对于人类新能源的开发,也是一个重要的启示。 蛋白质的三维结构还为生命物质的进化研究提供非常有用的信息。特别是那些一级结构相差甚远,功能已经完全迥异的一类蛋白质的所谓发散进化。研究它们的祖先同源性不可能依赖解剖学、组织学,甚至一级结构的测定工作。但有趣的是这一类蛋白质的三维结构却是保守的,尤其是活性部位的结构更不因一级结构的变化而改变。例如最近的三维结构研究表明,内分泌控制系统的大多数激素都属于一个家族。这一家族现在正在扩充它的成员,甚至包含来自血浆和神经传导物质的生长因子以及来自中枢神经系统的神经调节物质。胰岛素和胰岛素样生长因子的结构同源性就是例子。 70年代以来,核酸中的一类──tRNA的晶体结构分析、一些与 DNA专一性结合的蛋白质及其复合体的结构分析、以及组成染色质的基本单位核小体的结构分析使得生物大分子晶体学的发展进入一个新的阶段。这些工作为研究构成生命的两大类物质核酸-蛋白质的相互作用及其装配机制奠定了基础,并开始在分子水平上揭开基因的表达与调控之谜。最近完成的动物病毒如小儿麻痹病毒,感冒病毒的高分辨率的结构分析使得可能透彻研究这些最小的生命实体,具有深远的理论和实际意义。 近来,由于蛋白质晶体学与基因工程相结合,产生了蛋白质工程这一新的领域。利用这项技术,人们已经开始按照主观的愿望来设计和制造原来自然界中并不存在的蛋白质,其中包括治疗各种疾病的有效药物。 X 射线衍射技术在生物大分子结构与功能关系的研究中也有它的局限性。首先,这项技术要求待测结构的大分子必须长成单晶体。但在千万种生物大分子中能够结晶的仅是少数。很多具有重要生物学意义的生物大分子以及其他重要的生命物质还难以结晶,因而也就无法应用这项技术测定它们的结构。其次,这项技术只能测定生物大分子在晶态时按时间平均的静态构象。虽然已有一些事实证明这种结构与生物大分子在生理状态时的结构基本相同。但是生物大分子结构的更多奥妙在于它们的运动形式。它们的功能往往是在构象变化中表现出来的。近年来,由于二维核磁共振(NMR)及其他技术的发展,已有可能测定溶液中生物大分子的三维结构及其动态行为。 中子衍射技术氢原子在生物大分子的结构与功能中具有重要作用。但是它们对X射线的散射能力很弱,因而一般情况下很难由X射线衍射技术测定它们的位置。中子衍射技术正是用来弥补这个欠缺。中子具有波的性质。它的衍射原理与 X射线衍射相似。原子对中子的散射主要由原子核贡献。它们的散射能力由核结构决定,而与原子序数无一定关系。而且同一元素中各同位素原子的散射能力,由于核的结构不同而有显著的差别。甚至有些原子由于产生核内共振而使它们的散射振幅(或称散射长度)为负值。例如氢原子。但是它的同位素氘原子(2H或D)的散射振幅却大到与碳、 氧原子的数值相近[H=-3.8,D=6.7,C=6.6,O=5.8×10-12厘米]。利用这对同位素原子对于中子散射的不同性质,并通过D-H交换的办法,由氘原子取代分子及晶体结构中的氢原子,它们的位置就可由中子衍射技术测定。另外,新近有人还从氘氢交换前后两套衍射数据计算的 D2O-H2O差值中子密度图上,得到了有关蛋白质中水结构的更多信息。在这项技术的应用中,可举牛胰蛋白酶为例。在丝氨酸类蛋白酶水解肽键时伴随一个质子转移的过程。但不知这个质子最终定位何处。由量子化学计算及多种技术测量得到的结论各不相同。最后通过氘氢交换的晶体中子衍射研究,辨明这个质子定位在活性部位中57位组氨酸的咪唑环上。从而确定这个基团在催化过程中起碱催化作用。 中子衍射用的中子束一般来自核反应堆。但从反应堆引出的热中子流经准直和单色化后强度较弱,因此要求被测晶体大于2立方毫米,测量时间至少长达1~2个月。由于这些限制,使得至今还只有肌红蛋白、核糖核酸酶、胰蛋白酶、溶菌酶、甘比菜蛋白及牛胰蛋白酶抑制剂等少数生物大分子晶体已被用来进行中子衍射研究。 X射线纤维衍射技术生物大分子中的螺旋分子,如角蛋白、胶原及遗传物质 DNA(脱氧核糖核酸)等大多难以结晶(寡聚核苷酸例外),但能聚集成为纤维。平行排列这些纤维也能使 X射线发生衍射。这些螺旋分子的外形相似于弹簧,有可测量的螺距和半径。每圈螺旋包含数目相同的单元。因此它们的长轴方向具有周期结构的性质。它们的衍射花样呈X形,且在水平方向衍射点按层线排列。由X形的斜度及层线的间距可以计算螺距和半径。由中心至垂直最远衍射弧的距离可以计算单元间沿螺轴方向的距离。由于这些大分子的径向侧链处于无序状态,它们对X射线仅产生背景散射。因此纤维衍射技术无法测定大分子中原子的空间位置。但是如果结合考虑这些大分子的化学组份及立体化学等性质,也可由衍射花样推断该分子的结构模型。DNA分子的右手双螺旋模型(图3) 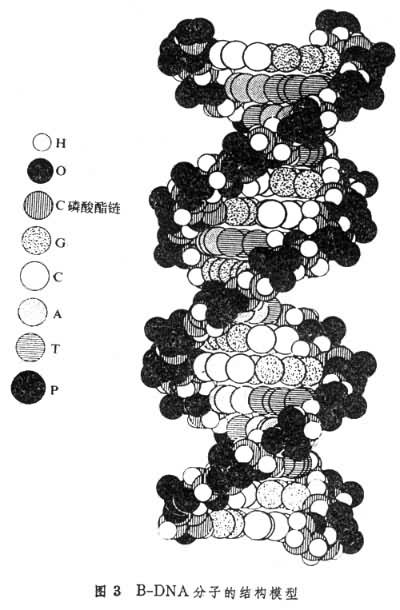
的建立是个典型的例子。这是由美国生物学家J.D.沃森和英国物理学家F.H.C.克里克于1953年提出来的。当时已知 DNA分子由多聚脱氧核苷酸链组成,并已知它是一种遗传物质。他们由纤维衍射的强度和花样(图4) 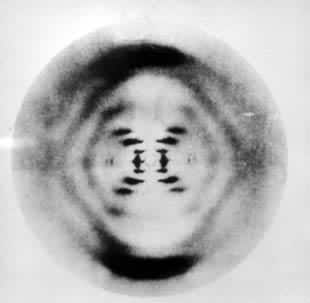
推断该分子为双螺旋结构,并算出它的螺距为34埃,每圈螺旋包含10个由氢键连接的嘌呤-嘧啶碱基对,螺旋半径为10埃。这个模型很好地解释了 DNA分子作为遗传物质的自我复制机制。 虽然纤维衍射所能提供的结构信息远比晶体衍射少,但是这项技术可以用来研究生物大分子在接近生理条件下的构象及其变化。例如当改变同一 DNA分子的相对湿度或离子含量时,它的构象可有A、B、C、S等几种类型的相互转换。采用由同步回旋加速器辐射产生的强 X射线,可以研究肌肉纤维收缩的运动模式。
|

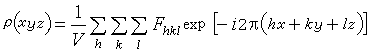 这个算式表示 ρ(xyz)等于
这个算式表示 ρ(xyz)等于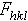 数值的傅立叶综合。式中V指晶胞体积,hkl称为衍射指标,表示衍射方向或反射的位置。ρ(xyz)是电子密度函数,表示晶胞中坐标为(xyz)点上电子密度的数值。电子密度峰的位置即为原子的中心位置。
数值的傅立叶综合。式中V指晶胞体积,hkl称为衍射指标,表示衍射方向或反射的位置。ρ(xyz)是电子密度函数,表示晶胞中坐标为(xyz)点上电子密度的数值。电子密度峰的位置即为原子的中心位置。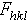 为复合波的振幅,称为结构振幅。它的平方值与衍射强度成正比关系,因此可由实验测定。指数
为复合波的振幅,称为结构振幅。它的平方值与衍射强度成正比关系,因此可由实验测定。指数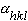 为复合波相对晶胞原点散射的相位差。对于生物大分子晶体,一般情况下它的值难以从衍射强度数据直接求得,因而也就无法直接由此计算电子密度函数。这是大分子晶体结构测定的主要困难所在,通常也被称为相位问题。
为复合波相对晶胞原点散射的相位差。对于生物大分子晶体,一般情况下它的值难以从衍射强度数据直接求得,因而也就无法直接由此计算电子密度函数。这是大分子晶体结构测定的主要困难所在,通常也被称为相位问题。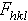 |≠|
|≠|


















