金属有机物的键型
|
[拼音]:jinshu youjiwu de jianxing [外文]:bonding types of organometallic compounds 金属有机物的金属-碳键大体上可有四种类型。 离子键型离子键是以金属正离子为一方,烃基负离子为另一方,依靠正负离子的静电作用结合而成。离子键型金属有机物是由电正性很强的、化学性质特别活泼的钠、钾、锶、钡等金属元素和烃基成键的化合物。烷基钠等通常是无色的,外形象盐;不溶于非极性有机溶剂如苯和四氯化碳等;离子性很强,烷基负离子的化学性质特别活泼,极易被水分解,对空气敏感;能导电。 较为稳定的烃基负离子如烯丙基、苄基、三苯甲基,和钾、钠正离子形成的烃基金属有机物能溶于乙醚。这类负离子带有显著的颜色,烃基的负电荷得到分散,金属正离子在乙醚溶液中被溶剂化,使这类离子性烃基金属较为稳定,可以结晶出来,未结晶前在溶液中有导电性。 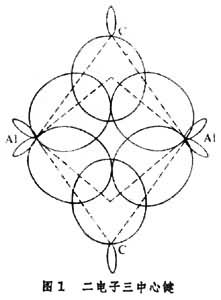 多中心键型
多中心键型
是电子对共用于三个或更多个原子之间的共价键。多中心键型金属有机物是由电正性金属如锂、铍、铝与烷基结合而成的金属有机物。金属的外层轨道在成键时轨道数目多于电子数,需要两个以上金属原子与一个碳原子共用一对电子来满足金属外层价电子数目的需要(图1)。为此,这类烃基金属往往几个分子缔合在一起,它们的缔合度随溶剂种类和温度而变异。低温有利于多中心键,高温下则多中心键分解。多中心键与配位键不同,配位键是配位体把成对电子给予缺电子的金属原子,金属接受配位体的数目是一定的。多中心键是轨道多于电子数,缔合的烃基金属中一个烃基与多个金属原子成键,缔合度不固定。其基本单元为RnM,n为金属M的化合价。 σ共价键型碳原子和金属原子各出一个电子,配对形成共用的一对电子,即有机化合物中的单键。一个金属原子提供电子成单键的数目就是该金属的化合价。共价键型金属有机物的分子式为RnM,一般能溶于有机溶剂,不溶于水,有挥发性,在溶液中不易导电。形成σ共价键型的活泼金属有机化合物能缔合并借助多中心键形成聚合物(RnM)x(x=2、4、6、…);不活泼的金属有机物只以单体状态存在。 金属原子用sp杂化轨道与两个烃基共价结合的化合物为直线型分子;用sp2杂化轨道与三个烃基结合,形成平面三角型分子;用sp3杂化轨道与四个烃基成键,形成四面体型分子。它们大多数是非过渡金属和烃基形成的化合物。 π共价键型是利用金属的(n-1)d轨道或其s、p、d 杂化轨道与碳原子的价键轨道重叠而成的共价键。一般,有机化合物的双键或叁键是利用碳原子的p轨道相互侧面重叠,与σ 键往往同时存在于两个碳原子之间。金属的p轨道能量高,不易与碳原子的p轨道重叠;金属的(n-1)d轨道能量较低,过渡金属原子的(n-1)d轨道中有电子而又不满,容易与碳原子的p轨道重叠。 金属原子的d轨道与某些有电子对的元素原子p轨道在形成σ 键之外也组成不牢固的π 键,叫d-pπ 键。这里p轨道上的电子对配给另一原子的空d轨道,也可以叫d-pπ配键(图2)。 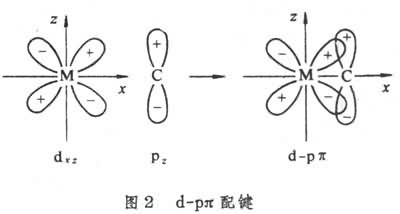
d-pπ键可有多种形式。具有π 键的烯、炔、苯、环戊二烯基等也可以其成键电子对作为给体与金属配位,金属原子的d空轨道与π 成键轨道重叠。 烯的成键π轨道有一个,苯的成键π轨道有三个,它们的电子数为2、6、…,d轨道也不止一个。因此,这类d-pπ 配键可按表所列电子数目分类。 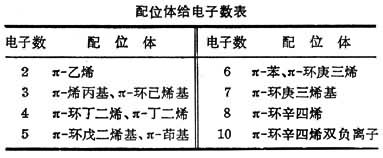
d-p配键主要是从有机配位体提供电子对给金属。如果配位体是羰基(CO),利用其杂化sp轨道上的两个电子配给金属,则由于其杂化轨道轴与金属d轨道轴在一条线上,这类配键与σ共价配键相当,称为σ配键(图3)。由此推理,有人把烯键的成键电子对给予金属也称为σ配键,不过这种σ配键是从烯键的π电子对提供的,轨道位相相同,键轴上下平面对称,具有某些σ键的特征(图4)。 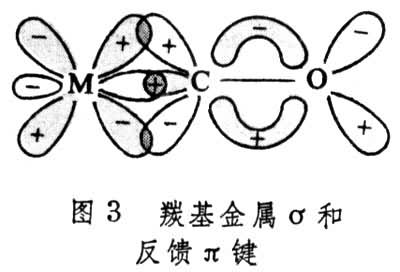
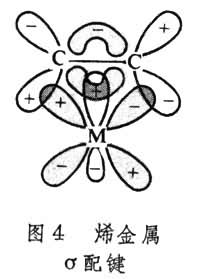
还有一种π反馈键,是金属原子d轨道上的电子进入有机分子的反键轨道而形成的键。例如,羰基和烯都有一个π反键轨道,它们是空的,能接受d轨道的电子。过渡金属有机物分子中往往同时存在π 键和π 反馈键,它们的位相是匹配的,有一定空间几何要求,像一般π 键,是镜面反对称垂直于键轴的(图3、4)。 具有特种键型的金属有机物的金属在周期表上分布如图5,这一分布不是绝对的,同一种金属有机物可能兼有两种以上的键型。 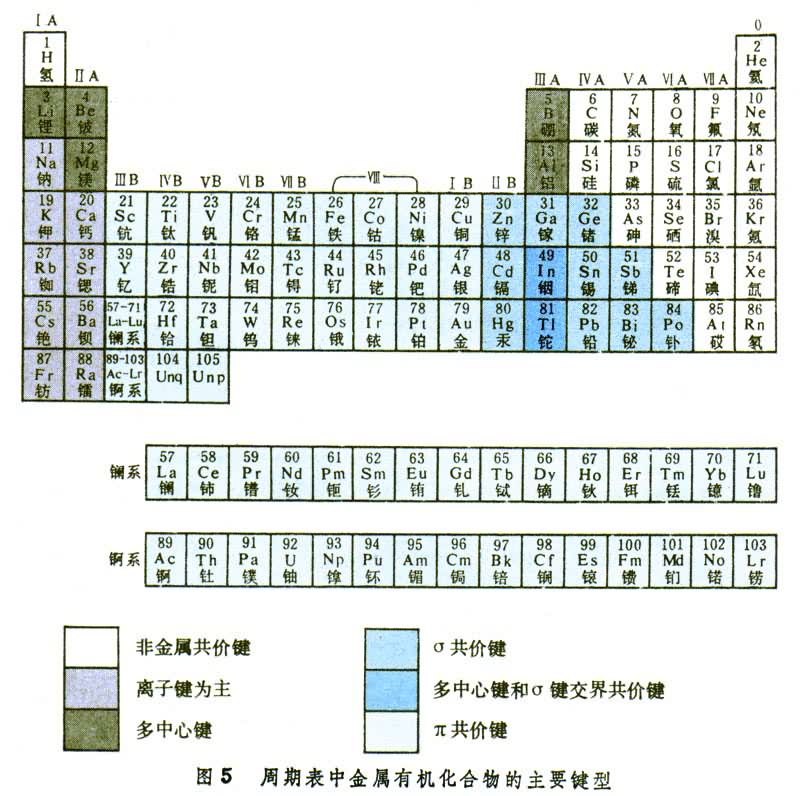
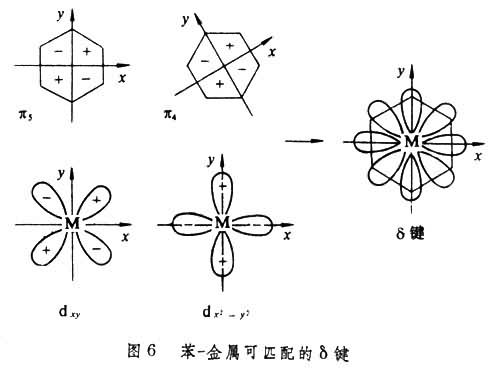
另外,在金属有机物分子中还有一种δ键,当有机配位体的反键轨道与金属的d轨道平面两两平行,从侧面匹配时,d电子部分地进入有机分子的平行轨道,这种键称为δ键(图6)。这种键对金属有机化合物的成键贡献不如σ 键和π键重要。
|




















