吸附
|
[拼音]:xifu [外文]:adsorption 物质从体相浓集到界面上的一种界面现象。例如,气相中的某些物质可以在固体表面上浓集;液体中的某些物质可以在气-液界面、液-液界面和固-液界面上浓集。通常把能有效地吸附其他物质的固体称为吸附剂,被吸附的物质称为吸附质。 根据吸附剂与吸附质分子间作用力的性质可将吸附作用分为物理吸附和化学吸附,在物理吸附中被吸附分子保持其原来的化学本性,而化学吸附则是吸附质与吸附剂形成表面化合物。 吸附研究中最重要的物理量是吸附量,它常用单位重量吸附剂上吸附物质的量(摩尔/克、毫升/克、克/克)或单位面积吸附剂上吸附物质的量(毫摩尔/米2,分子数/100埃2)来表示。吸附量不仅与吸附剂、吸附质的性质有关,而且与吸附质在体相中的浓度、吸附温度等因素有关。吸附作用常伴随有热效应产生。物理吸附热较低,一般与吸附质的凝聚热相近;而化学吸附热较高,一般接近化学反应热。 被吸附分子在界面上有一定的活动性,它们在一定的条件下也可以逃离界面重新进入体相,称为脱附。单位时间的吸附量称为吸附速度,当吸附速度与脱附速度相等时即达到吸附平衡,因此吸附平衡是一种动态平衡。 J.W.吉布斯最早提出了吸附作用的热力学关系,它说明了吸附量与界面张力的联系,对于各种界面都有重要的理论和实际意义。 在一定温度下平衡吸附量与吸附质浓度(或压力)的关系曲线称为吸附等温线,描述吸附等温线的方程式称为吸附等温线方程。吸附等温线有多种形式,因而从各种理论模型出发,经过一定的数学处理得到的吸附等温线方程也有许多种。利用这些方程可以得到有关吸附剂、吸附质和吸附过程特点的有用信息,但是至今这些等温线方程大多还只是半经验的。 吸附作用在石油、化工、轻工、医药、农业等部门都得到广泛的应用,例如,从气体和液体中回收有用物质或去除某些杂质;反应物分子在催化剂上的吸附是多相催化反应的基本条件(见催化);色谱和某些分析方法也应用吸附作用的原理;去污、乳化、破乳、粉碎、浮选等过程和改变界面的某些物理化学性质的方法都离不开在界面上的吸附作用。 溶液表面的吸附溶液是由溶剂和溶质组成的,在纯溶剂中,只存在溶剂分子间的作用力,由于溶质的加入,使分子间的作用力变得复杂,作用力场弱的分子将聚集在表面,导致了溶液表面浓度与内部浓度的差别,这种现象即为溶液表面的吸附。在溶液表面上溶质的浓度可以大于、等于或小于溶液内部溶质的浓度,分别称为正吸附、不吸附和负吸附。显然,发生溶液表面吸附时溶液的表面张力与纯溶剂的不同。 对于水溶液,表面张力随溶质浓度的变化分三种情况: (1)大多数无机盐溶液表面张力随盐浓度增加而缓慢地近似于直线地升高; (2)大多数低分子有机物溶液的表面张力随溶质浓度增加而缓慢下降,开始时降得快一些,后来则较慢; (3)表面活性剂溶液的表面张力在其浓度很低时就急剧下降,达到一定浓度后几乎不再有明显变化。 1876年吉布斯应用热力学导出了在一定温度下溶液表面吸附量与表面张力、溶液浓度的关系: 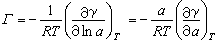
此式称为吉布斯定理,式中Γ为溶质在单位表面上的吸附量;a为溶液中溶质的活度;γ为溶液的表面张力;R为气体常数;T为热力学温度。当溶液浓度很小时可用浓度c代替活度,得到: 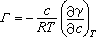
此式适用于非电解质;若为产生两个离子的电解质,则在RT前有系数2。 由吉布斯定理可知:(дγ/дc)T<0时,Γ>0,即一种溶质若能降低溶剂的表面张力,则该物质在表面上的浓度大于内部的浓度,为正吸附;(дγ/дc)T>0时,Γ<0,即能升高溶剂表面张力的溶质在表面上的浓度小于内部的浓度,为负吸附。Γ是溶液单位表面上的溶质与溶液内部相比时多出(或减少)的量,即过剩量,它并不是溶液单位表面上溶质的真正浓度。只有当溶液内部浓度很低,且表面吸附量很大(如表面活性剂溶液)时,表面过剩量比溶液内部浓度大得多、Γ才可近似看作是表面浓度。由实验可测得表面张力随浓度变化的关系曲线,从而可得出(дγ/дc)T值,利用吉布斯定理即可计算出实验温度下的Γ值。 吉布斯定理是从热力学推导出来的,对界面的性质未作规定,故它适用于一切界面上的吸附现象,但在固-气和固-液界面上,由于固体界面张力随溶液浓度变化的关系不易测定,故不能用以计算吸附量;而固体自气体和溶液中的吸附量却是不难直接测定的,因而有时可以利用吉布斯定理了解吸附时固体界面张力的变化。 定向吸附兼有极性基和非极性基的两亲性有机分子(如表面活性剂分子)在水溶液表面都是正吸附,在一定温度下吸附量与浓度的关系常具有朗缪尔吸附等温式的类似形式,即在浓度很低时吸附量与浓度间有正比关系,在浓度很大时吸附量为恒定值,不再随浓度变化,此时达到饱和吸附。 实验证明,对于直链脂肪酸、醇、胺,饱和吸附量(毫摩尔/厘米2)是相同的,与碳链长?任薰兀创锏奖ズ臀绞保鲜龌衔锩扛龇肿铀嫉拿婊窍嘟摹@纾笛椴獾弥绷粗舅帷⒋肌反锏奖ズ臀绞泵扛龇肿幽苷嫉拿婊直鸫笤嘉?31埃2、28埃2、27埃2。这一结果可以用饱和吸附时分子采取定向排列的方式来解释,在饱和吸附时分子的极性基插入水中,非极性基伸向气相,每个分子在表面上所占的面积是该分子的有效截面积,与非极性基的链长无关。 在不相混溶的极性和非极性液体界面上,两亲性有机分子的定向吸附作用更为明显,这是因为非极性液体与两亲性分子中非极性基团的性质更相近。在固-液界面上,两亲性分子也可有定向吸附作用,其取向由固体表面和溶剂的性质决定。 固-液界面的吸附不溶性固体与液体接触,溶液中某些组分会在固体表面富集,即为固体从溶液中的吸附作用。固-液界面的吸附应用很广,研究得也很早,但由于固体表面结构和溶液结构的复杂性,至今对吸附机理的了解还很不够。 固体自二元互溶液体中的吸附等温线主要有U形和S形两种(图1 ), 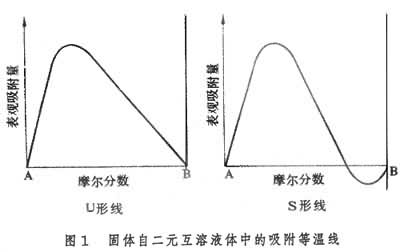
前者表示某一组分在完整的体相溶液构成中都优先吸附;后者表示在不同溶液组成时优先吸附的组分不同。应用最多的是固体在稀溶液中的吸附等温线,稀溶液的吸附等温线形状则是多种多样的。 现时应用最多的溶液吸附等温式有朗缪尔公式: 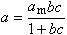
和弗罗因德利希吸附公式: 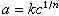
式中a是平衡浓度为c时的吸附量;am是单分子层饱和吸附量;b、k和n均为常数。 影响固体自溶液中吸附的因素很多,一般可从溶质、溶剂和吸附剂三者间的关系来考虑。对于小的有机和无机物分子,若以分子状态吸附时至少有以下规律: (1)稀溶液时,随着浓度增加,固-液界面自由能降低多的溶质吸附量大,如炭从水溶液中吸附同系有机物分子时,其吸附量随碳链增加而有规律地增加,这称为特劳贝规则; (2)吸附与溶解是性质相反的过程,故溶解度越小越容易被吸附; (3)吸附是放热过程,温度升高一般对吸附不利,即温度升高,吸附量下降; (4)极性吸附剂容易从极性弱的溶剂中吸附极性强的溶质;非极性吸附剂容易从极性强的溶剂中吸附极性弱的溶质。例如,非极性的活性炭容易从极性强的水中吸附有机物。其他如溶质的分子结构、溶剂的性质、吸附剂的制备条件等都对吸附有影响,其原因大多是由于这些因素影响了溶解度、吸附剂的性质等,改变了溶质、溶剂、吸附剂三者间的复杂关系而造成的。 固体从溶液中吸附电解质有三种情况: (1)有些电解质(如弱电解质)以分子状态吸附,其吸附规律与小分子吸附相似。 (2)有些固体在中性盐水溶液中吸附时,溶液的pH值发生变化,就像盐类发生了水解反应,固体有选择地吸附酸或碱。这种吸附作用称为水解吸附。 (3)电解质在溶液中解离后某种离子被固体表面吸附,另一种反离子处于固体表面附近的扩散层中,这些反离子可以被与其同号的离子所交换。有些离子直接与固体骨架上的某些离子发生交换作用,这两种因固体吸附而发生的交换过程统称离子交换吸附。固体表面优先吸附哪种离子是由电解质和固体的性质所决定的,一般来说,能与固体表面某些原子或原子团形成不电离、不溶解物质的离子具有优先吸附的条件。离子交换吸附在土壤学和工业生产中有重要应用。 固体从溶液中吸附大分子远比吸附小分子复杂。每个大分子可有若干个吸附点,因而在较小浓度时吸附量上升很快,许多大分子吸附等温线服从朗缪尔公式的类似形式。由于大分子分子量大,在多孔性固体上吸附时有些小孔分子不能进入,故分子量增加,吸附量反而减小。溶剂、吸附剂的性质等对大分子的吸附也有影响,在实际问题中要综合考虑。 固-气界面的吸附固体表面的原子或分子所受的力是不对称的,当气体分子与其接触时有一部分受表面吸引而暂时停留,因而使固体表面上气体的浓度增加,这种现象称为固-气界面的吸附。固-气界面的吸附也可分为物理吸附和化学吸附两类,二者虽有本质的区别,但在实际体系中有时却是并存的。 吸附过程是自发过程,故吸附过程的自由能减小。发生吸附时,被吸附的气体分子自由度比在气相中减少,混乱度也减少,因此,吸附过程为放热过程。吸附热效应一般有两种:在一定温度下,单位吸附剂上吸附1摩尔气体所放出的热量称为积分吸附热,它反映了吸附过程中较长时间热量变化的平均结果;在一定温度下,吸附了一定量气体后再吸附少量气体放出的热量称为微分吸附热,它反映了吸附过程中某一瞬间的热量变化。 测定吸附量的方法一般有动态法和静态法两种。动态法基本原理是用含一定分压吸附质的气体与其他惰性气体的混合气通过经预先处理和称量的吸附剂,达到吸附平衡后,直接称量吸附剂的增量;或用气相色谱法测定被吸附气体的量以计算吸附量。静态法又分容量法和重量法两种,它们都是将一定量吸附剂封闭在真空系统中,再通入一定量吸附质气体。容量法利用改变该气体的体积,测定平衡压力以计算吸附量;重量法则用灵敏的称量装置直接测量吸附剂的增量,同时测定吸附平衡压力。 对于指定的吸附质和吸附剂,吸附量与吸附温度和气体平衡压力有关。吸附量、吸附温度和气体平衡压力三参数中任意二参数间的关系曲线称为吸附曲线。当温度一定时吸附量与气体平衡压力间的关系曲线称为吸附等温线。综合大量的实验结果,气体吸附等温线主要有五种类型(图2)。 
|



















